Table des matières
L'évaluation d'une usine d'endoscopie nécessite un cadre d'évaluation de la conformité réglementaire, des contrôles de production, des capacités d'ingénierie et de la gestion des fournisseurs. Pour les responsables des achats hospitaliers et les distributeurs médicaux, cette diligence raisonnable garantit la sécurité des patients, la fiabilité des dispositifs et un coût total de possession optimal. Ce guide présente les principaux piliers de l'audit des systèmes qualité et de la viabilité à long terme d'un partenaire industriel potentiel, allant au-delà des spécifications pour s'attaquer aux processus fondamentaux.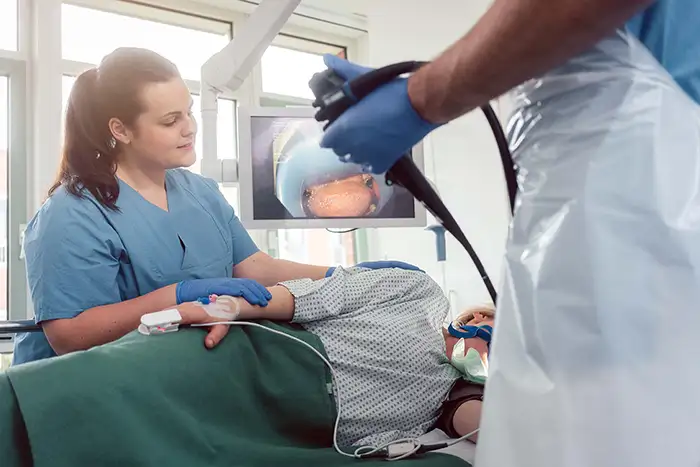
L’évaluation de l’excellence de la fabrication nécessite une évaluation approfondie des systèmes de qualité fondamentaux et des normes de production.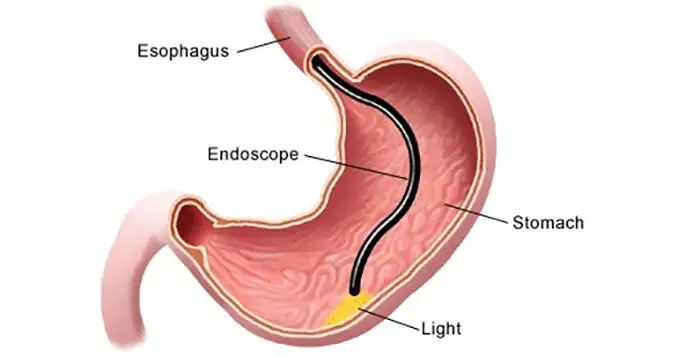
Certification ISO 13485 valide pour les systèmes de fabrication de dispositifs médicaux
Enregistrement réussi auprès de la FDA et documentation d'autorisation de mise sur le marché
Conformité au MDR de l'UE et préparation du dossier technique
Normes internationales de sécurité électrique, y compris la série IEC 60601
Protocoles certifiés de classification et de maintenance des salles blanches
Systèmes de surveillance environnementale pour le contrôle de la température et de l'humidité
Mesures de prévention de la contamination particulaire
Validation de la stérilisation et tests d'intégrité de l'emballage
La qualité de fabrication s’étend au-delà de la conformité pour englober l’expertise technique et la capacité d’innovation.
Composition et expertise d'une équipe d'ingénierie multidisciplinaire
Mise en œuvre et documentation du processus de contrôle de conception
Méthodologie de gestion des risques selon la norme ISO 14971
Capacités de prototypage et protocoles de tests de vérification
Mise en œuvre de systèmes d'inspection optique automatisés
Techniques d'usinage et d'assemblage de précision
Assistance robotique dans les opérations d'assemblage complexes
Surveillance de la production en temps réel et collecte de données
Une assurance qualité complète exige l’excellence tout au long de la chaîne d’approvisionnement et de l’écosystème de fabrication.
Processus de spécification et de vérification des matières premières
Procédures d'audit des fournisseurs et suivi des performances
Systèmes de traçabilité des composants et contrôle des lots
Protocoles d'inspection entrants et critères d'acceptation
Points de contrôle de la qualité en cours de processus
Mise en œuvre du contrôle statistique des processus
Test du produit final et validation des performances
Procédures de manutention non conformes
La qualité de fabrication durable démontre un engagement à travers un soutien continu et une amélioration systématique.
Disponibilité du réseau mondial de support technique
Capacités de service de réparation et d'entretien
Ressources de formation et d'éducation cliniques
Gestion des stocks de pièces de rechange
Mise en œuvre du système de surveillance post-commercialisation
Collecte et analyse des commentaires des clients
Suivi des indicateurs de performance sur le terrain
Documentation du processus d'amélioration continue
L'évaluation complète d'une usine d'endoscopie nécessite une analyse multidimensionnelle de l'excellence de la fabrication. Cette approche structurée permet de prendre des décisions de partenariat éclairées, fondées sur des capacités démontrées et des performances qualité durables.
Copyright © 2025.Geekvalue Tous droits réservés.Support technique : TiaoQingCMS